पदार्थ अल्केन्स। उपयोगी वीडियो: अल्केन्स - आणविक संरचना, भौतिक गुण
तालिका कई अल्केन्स और उनके रेडिकल के कुछ प्रतिनिधियों को दिखाती है।
|
सूत्र |
नाम |
कट्टरपंथी का नाम |
|||||||||||
|
CH3 मिथाइल |
|||||||||||||
|
C3H7 प्रोपाइल |
|||||||||||||
|
C4H9 ब्यूटाइल |
|||||||||||||
|
आइसोब्यूटेन |
आइसोबुटिल |
||||||||||||
|
आइसोपेंटेन |
आइसोपेंटाइल |
||||||||||||
|
नियोपेंटेन |
नियोपेंटाइल |
||||||||||||
|
तालिका से पता चलता है कि ये हाइड्रोकार्बन समूहों की संख्या में एक दूसरे से भिन्न होते हैं - CH2 -। संरचना में समान, समान रासायनिक गुणों वाले और इन समूहों की संख्या में एक दूसरे से भिन्न की ऐसी श्रृंखला कहलाती है सजातीय श्रृंखला. और जो पदार्थ इसे बनाते हैं उन्हें होमोलॉग कहा जाता है। होमोलॉग्स - संरचना और गुणों में समान पदार्थ, लेकिन एक या एक से अधिक समरूप अंतर (- CH2 -) द्वारा संरचना में भिन्न
कार्बन श्रृंखला - ज़िगज़ैग (यदि n 3) - बांड (बॉन्ड के चारों ओर मुक्त रोटेशन) लंबाई (-С-С-) 0.154 एनएम बाध्यकारी ऊर्जा (-С-С-) 348 kJ/mol अल्केन अणुओं में सभी कार्बन परमाणु sp3 संकरण की स्थिति में होते हैं
के बीच का कोण सी-सी बांड 109 ° 28 "है, इसलिए, बड़ी संख्या में कार्बन परमाणुओं के साथ सामान्य अल्केन्स के अणुओं में एक ज़िगज़ैग संरचना (ज़िगज़ैग) होती है। संतृप्त हाइड्रोकार्बन में सीसी बांड की लंबाई 0.154 एनएम (1 एनएम = 1 * 10-9 मीटर) होती है। क) इलेक्ट्रॉनिक और संरचनात्मक सूत्र; बी) स्थानिक संरचना
4. संवयविता- C4 . के साथ श्रृंखला के संरचनात्मक समरूपता द्वारा विशेषता इनमें से एक आइसोमर ( एन-ब्यूटेन) में एक असंबद्ध कार्बन श्रृंखला होती है, और दूसरी - आइसोब्यूटेन - शाखित (आइसोस्ट्रक्चर)। एक शाखित श्रृंखला में कार्बन परमाणु अन्य कार्बन परमाणुओं के साथ संबंध के प्रकार में भिन्न होते हैं। इस प्रकार, केवल एक अन्य कार्बन परमाणु से बंधे कार्बन परमाणु को कहा जाता है मुख्य, दो अन्य कार्बन परमाणुओं के साथ - माध्यमिक, तीन के साथ - तृतीयक, चार . के साथ चारों भागों का. अणुओं की संरचना में कार्बन परमाणुओं की संख्या में वृद्धि के साथ, श्रृंखला शाखाओं की संभावना बढ़ जाती है, अर्थात। आइसोमर्स की संख्या कार्बन परमाणुओं की संख्या के साथ बढ़ती है। होमोलॉग और आइसोमर्स की तुलनात्मक विशेषताएं
1. उनका अपना नामकरण है कण(हाइड्रोकार्बन रेडिकल्स)
| |||||||||||||
अल्केन्स संतृप्त हाइड्रोकार्बन हैं। उनके अणुओं में, परमाणुओं में एकल बंधन होते हैं। संरचना सूत्र CnH2n+2 द्वारा निर्धारित की जाती है। अल्केन्स पर विचार करें: रासायनिक गुण, प्रकार, अनुप्रयोग।
कार्बन की संरचना में चार कक्षाएँ होती हैं जिनके साथ परमाणु घूमते हैं। ऑर्बिटल्स का आकार, ऊर्जा समान होती है।
ध्यान दें!उनके बीच के कोण 109 डिग्री और 28 मिनट हैं, उन्हें टेट्राहेड्रोन के शीर्ष पर निर्देशित किया जाता है।
एक साधारण कार्बन बंधन अल्केन अणुओं को स्वतंत्र रूप से घूमने की अनुमति देता है, जिसके परिणामस्वरूप संरचनाएं प्राप्त होती हैं विभिन्न रूप, कार्बन परमाणुओं पर शिखर बनाते हैं।
सभी एल्केन यौगिकों को दो मुख्य समूहों में बांटा गया है:
- एक स्निग्ध यौगिक के हाइड्रोकार्बन। ऐसी संरचनाओं का एक रैखिक संबंध होता है। सामान्य सूत्र इस तरह दिखता है: CnH2n+2। n का मान एक के बराबर या उससे अधिक है, अर्थात कार्बन परमाणुओं की संख्या।
- चक्रीय संरचना के साइक्लोअल्केन्स। रासायनिक गुणचक्रीय एल्केन्स रैखिक यौगिकों के गुणों से काफी भिन्न होते हैं। साइक्लोअल्केन्स का सूत्र कुछ हद तक उन्हें हाइड्रोकार्बन के समान बनाता है जिसमें एक ट्रिपल परमाणु बंधन होता है, जो कि अल्काइन्स के लिए होता है।
अल्केन्स के प्रकार
अल्केन यौगिक कई प्रकार के होते हैं, जिनमें से प्रत्येक का अपना सूत्र, संरचना, रासायनिक गुण और एल्काइल प्रतिस्थापन होता है। तालिका में समजातीय श्रृंखला शामिल है

अल्केन्स का नाम
संतृप्त हाइड्रोकार्बन का सामान्य सूत्र CnH2n+2 है। n के मान में परिवर्तन करने पर सरल अंतरपरमाण्विक बंध वाला यौगिक प्राप्त होता है।
उपयोगी वीडियो: अल्केन्स - आणविक संरचना, भौतिक गुण
अल्केन्स की किस्में, प्रतिक्रिया विकल्प
में विवोअल्केन्स रासायनिक रूप से निष्क्रिय यौगिक हैं। हाइड्रोकार्बन नाइट्रिक और सल्फ्यूरिक एसिड, क्षार और पोटेशियम परमैंगनेट के सांद्रण के संपर्क में आने पर प्रतिक्रिया नहीं करते हैं।
एकल आणविक बंधन अल्केन्स की प्रतिक्रियाओं की विशेषता निर्धारित करते हैं। अल्केन श्रृंखलाओं को एक गैर-ध्रुवीय और कमजोर ध्रुवीकरण बंधन की विशेषता है। यह S-N से कुछ लंबा है।

अल्केन्स का सामान्य सूत्र
प्रतिस्थापन प्रतिक्रिया
पैराफिन पदार्थ नगण्य रासायनिक गतिविधि में भिन्न होते हैं। यह चेन बॉन्ड की बढ़ी हुई ताकत से समझाया गया है, जिसे तोड़ना आसान नहीं है। विनाश के लिए, एक घरेलू तंत्र का उपयोग किया जाता है, जिसमें मुक्त कण भाग लेते हैं।
अल्केन्स के लिए, प्रतिस्थापन प्रतिक्रियाएं अधिक स्वाभाविक हैं। वे पानी के अणुओं और आवेशित आयनों पर प्रतिक्रिया नहीं करते हैं। प्रतिस्थापन के दौरान, हाइड्रोजन कणों को हलोजन और अन्य सक्रिय तत्वों द्वारा प्रतिस्थापित किया जाता है। इन प्रक्रियाओं में हैलोजन, नाइट्रेशन और सल्फोक्लोरिनेशन शामिल हैं। इस तरह की प्रतिक्रियाओं का उपयोग अल्केन डेरिवेटिव बनाने के लिए किया जाता है।
मुक्त मूलक प्रतिस्थापन तीन मुख्य चरणों में होता है:
- एक श्रृंखला की उपस्थिति जिसके आधार पर मुक्त कण बनाए जाते हैं। ताप और पराबैंगनी प्रकाश का उपयोग उत्प्रेरक के रूप में किया जाता है।
- एक श्रृंखला का विकास जिसकी संरचना में सक्रिय और निष्क्रिय कणों की परस्पर क्रिया होती है। इस प्रकार अणु और मूलक कण बनते हैं।
- अंत में, श्रृंखला समाप्त हो जाती है। सक्रिय तत्व नए संयोजन बनाते हैं या पूरी तरह से गायब हो जाते हैं। श्रृंखला अभिक्रियासमाप्त होता है।
हैलोजनीकरण
प्रक्रिया कट्टरपंथी है। हाइड्रोकार्बन और हलोजन मिश्रण के पराबैंगनी विकिरण और थर्मल हीटिंग के प्रभाव में हलोजन होता है।
पूरी प्रक्रिया मार्कोवनिकोव के नियम के अनुसार होती है। इसका सार इस तथ्य में निहित है कि हाइड्रोजनीकृत कार्बन से संबंधित हाइड्रोजन परमाणु सबसे पहले हैलोजेनेटेड होता है। प्रक्रिया एक तृतीयक परमाणु से शुरू होती है और प्राथमिक कार्बन के साथ समाप्त होती है।
सल्फोक्लोरिनेशन
दूसरा नाम रीड रिएक्शन है। यह मुक्त मूलक प्रतिस्थापन की विधि द्वारा किया जाता है। इस प्रकार, अल्केन्स पराबैंगनी विकिरण के प्रभाव में सल्फर डाइऑक्साइड और क्लोरीन के संयोजन की क्रिया पर प्रतिक्रिया करते हैं।
प्रतिक्रिया श्रृंखला तंत्र की सक्रियता के साथ शुरू होती है। इस समय क्लोरीन से दो रेडिकल निकलते हैं। एक की क्रिया एल्केन की ओर निर्देशित होती है, जिसके परिणामस्वरूप हाइड्रोजन क्लोराइड का एक अणु और एक एल्काइल तत्व का निर्माण होता है। एक अन्य कट्टरपंथी सल्फर डाइऑक्साइड के साथ मिलकर एक जटिल संयोजन बनाता है। संतुलन के लिए, एक क्लोरीन परमाणु दूसरे अणु से लिया जाता है। परिणाम एक अल्केन सल्फोनील क्लोराइड है। इस पदार्थ का उपयोग सतह-सक्रिय घटकों के उत्पादन के लिए किया जाता है।

सल्फोक्लोरिनेशन
नाइट्रट करना
नाइट्रेशन प्रक्रिया में गैसीय टेट्रावैलेंट नाइट्रोजन ऑक्साइड और नाइट्रिक एसिड के साथ संतृप्त कार्बन का संयोजन शामिल होता है, जिसे 10% घोल में लाया जाता है। प्रतिक्रिया के लिए निम्न स्तर के दबाव और उच्च तापमान की आवश्यकता होगी, लगभग 104 डिग्री। नाइट्रेशन के परिणामस्वरूप नाइट्रोऐल्केन प्राप्त होते हैं।
बंटवारा
परमाणुओं को अलग करके, डिहाइड्रोजनीकरण प्रतिक्रियाएं की जाती हैं। मीथेन का आणविक कण तापमान के प्रभाव में पूरी तरह से विघटित हो जाता है।
निर्जलीकरण
यदि हाइड्रोजन परमाणु को पैराफिन (मीथेन को छोड़कर) की कार्बन जाली से अलग किया जाता है, तो असंतृप्त यौगिक बनते हैं। ये प्रतिक्रियाएं महत्वपूर्ण तापमान स्थितियों (400-600 डिग्री) की स्थितियों में की जाती हैं। विभिन्न धातु उत्प्रेरक का भी उपयोग किया जाता है।
असंतृप्त हाइड्रोकार्बनों का हाइड्रोजनीकरण करने से ऐल्केन प्राप्त होते हैं।
अपघटन प्रक्रिया
एल्केन प्रतिक्रियाओं के दौरान तापमान के प्रभाव में, आणविक बंधों का टूटना और सक्रिय रेडिकल्स की रिहाई हो सकती है। इन प्रक्रियाओं को पायरोलिसिस और क्रैकिंग के रूप में जाना जाता है।
जब प्रतिक्रिया घटक को 500 डिग्री तक गर्म किया जाता है, तो अणु विघटित होने लगते हैं, और उनके स्थान पर जटिल रेडिकल एल्काइल मिश्रण बनते हैं। इस प्रकार उद्योग में ऐल्केन तथा ऐल्कीन प्राप्त होते हैं।
ऑक्सीकरण
इस रसायनिक प्रतिक्रियाइलेक्ट्रॉन दान पर आधारित पैराफिन की विशेषता ऑटोऑक्सीडेशन है। प्रक्रिया मुक्त कणों द्वारा संतृप्त हाइड्रोकार्बन के ऑक्सीकरण का उपयोग करती है। तरल अवस्था में अल्केन यौगिक हाइड्रोपरॉक्साइड में परिवर्तित हो जाते हैं। सबसे पहले, पैराफिन ऑक्सीजन के साथ प्रतिक्रिया करता है। सक्रिय रेडिकल बनते हैं। फिर ऐल्किल कण ऑक्सीजन के दूसरे अणु से अभिक्रिया करता है। एक पेरोक्साइड रेडिकल बनता है, जो बाद में एल्केन अणु के साथ इंटरैक्ट करता है। प्रक्रिया के परिणामस्वरूप, हाइड्रोपरॉक्साइड जारी किया जाता है।

अल्केन ऑक्सीकरण प्रतिक्रिया
अल्केन्स का अनुप्रयोग
लगभग सभी प्रमुख क्षेत्रों में कार्बन यौगिकों का व्यापक रूप से उपयोग किया जाता है मानव जीवन. कुछ प्रकार के यौगिक कुछ उद्योगों और आधुनिक मनुष्य के आरामदायक अस्तित्व के लिए अपरिहार्य हैं।
गैसीय अल्केन्स मूल्यवान ईंधन का आधार हैं। अधिकांश गैसों का मुख्य घटक मीथेन है।
मीथेन में बनाने और छोड़ने की क्षमता है एक बड़ी संख्या कीगर्मी। इसलिए, इसका उपयोग उद्योग में महत्वपूर्ण मात्रा में, घर पर उपभोग के लिए किया जाता है। ब्यूटेन और प्रोपेन को मिलाने पर एक अच्छा घरेलू ईंधन प्राप्त होता है।
ऐसे उत्पादों के उत्पादन में मीथेन का उपयोग किया जाता है:
- मेथनॉल;
- विलायक;
- फ़्रीऑन;
- स्याही;
- ईंधन;
- संश्लेषण गैस;
- एसिटिलीन;
- फॉर्मलडिहाइड;
- फॉर्मिक एसिड;
- प्लास्टिक।

मीथेन अनुप्रयोग
तरल हाइड्रोकार्बन को इंजन और रॉकेट, सॉल्वैंट्स के लिए ईंधन बनाने के लिए डिज़ाइन किया गया है।
उच्च हाइड्रोकार्बन, जहां कार्बन परमाणुओं की संख्या 20 से अधिक होती है, स्नेहक, पेंट और वार्निश, साबुन और डिटर्जेंट के उत्पादन में शामिल होते हैं।
15 एच से कम परमाणुओं वाले फैटी हाइड्रोकार्बन का संयोजन पैराफिन तेल है। इस बेस्वाद पारदर्शी तरल का उपयोग सौंदर्य प्रसाधनों में, इत्र के निर्माण में और चिकित्सा प्रयोजनों के लिए किया जाता है।
वैसलीन 25 से कम कार्बन परमाणुओं के साथ ठोस और वसायुक्त अल्केन्स के संयोजन का परिणाम है। पदार्थ चिकित्सा मलहम के निर्माण में शामिल है।
ठोस एल्केन्स के संयोजन से प्राप्त पैराफिन एक ठोस, बेस्वाद द्रव्यमान है, सफेद रंगऔर बिना सुगंध के। पदार्थ का उपयोग मोमबत्तियों के उत्पादन के लिए किया जाता है, कागज और माचिस लपेटने के लिए एक संसेचन पदार्थ। पैराफिन कॉस्मेटोलॉजी और चिकित्सा में थर्मल प्रक्रियाओं के कार्यान्वयन में भी लोकप्रिय है।
ध्यान दें!अल्केन मिश्रण से सिंथेटिक फाइबर, प्लास्टिक, डिटर्जेंट रसायन और रबर भी बनाए जाते हैं।
हलोजनयुक्त अल्केन यौगिक सॉल्वैंट्स, रेफ्रिजरेंट और आगे के संश्लेषण के लिए मुख्य पदार्थ के रूप में भी कार्य करते हैं।
उपयोगी वीडियो: अल्केन्स - रासायनिक गुण
उत्पादन
अल्केन्स एक रेखीय या शाखित संरचना वाले चक्रीय हाइड्रोकार्बन यौगिक हैं। परमाणुओं के बीच एक एकल बंधन स्थापित होता है, जो अविनाशी होता है। इस प्रकार के यौगिकों की विशेषता अणुओं के प्रतिस्थापन के आधार पर अल्केन्स की प्रतिक्रियाएं। सजातीय श्रृंखला में सामान्य संरचनात्मक सूत्र CnH2n+2 है। हाइड्रोकार्बन संतृप्त वर्ग से संबंधित हैं क्योंकि उनमें हाइड्रोजन परमाणुओं की अधिकतम स्वीकार्य संख्या होती है।
परिभाषा 1
हाइड्रोकार्बनऐसे हाइड्रोकार्बन, कार्बन परमाणु कहलाते हैं, जिनके अणु सरल (एकल) $\sigma $-bonds द्वारा परस्पर जुड़े होते हैं। इन यौगिकों में कार्बन परमाणुओं की अन्य सभी संयोजकता इकाइयाँ हाइड्रोजन परमाणुओं के साथ व्याप्त (संतृप्त) हैं।
संतृप्त हाइड्रोकार्बन अणुओं में कार्बन परमाणु पहली संयोजकता अवस्था में होते हैं, अर्थात $sp3$ संकरण अवस्था में। इन संतृप्त हाइड्रोकार्बन को भी कहा जाता है पैराफिन.
ये पैराफिन कार्बनिक यौगिकबुलाया क्योंकि लंबे समय तकउन्हें कम प्रतिक्रियाशील माना जाता था (अक्षांश से। परुम- कुछ और एफिनिस- एक आत्मीयता है)।
संतृप्त हाइड्रोकार्बन का पुराना नाम स्निग्ध या वसायुक्त, हाइड्रोकार्बन (अक्षांश से। स्निग्ध- साहसिक)। यह नाम पहले अध्ययन किए गए यौगिकों के नाम से आया है जिन्हें एक बार इन पदार्थों - वसा के लिए जिम्मेदार ठहराया गया था।
संतृप्त हाइड्रोकार्बन सामान्य सूत्र $C_nH_((2_n+2))$$(n - 1, 2, 3, 4, ...)$ के साथ यौगिकों की एक श्रृंखला बनाते हैं। इस श्रृंखला का एक साधारण यौगिक मीथेन $CH_4$ है। इसलिए, इनमें से कई यौगिकों को कई मीथेन हाइड्रोकार्बन भी कहा जाता है।
समजातीय श्रृंखला
मीथेन श्रृंखला के यौगिकों में समान संरचना और गुण होते हैं। यौगिकों की ऐसी श्रृंखला, जिनके प्रतिनिधियों में समान रासायनिक गुण होते हैं और भौतिक गुणों में नियमित परिवर्तन की विशेषता होती है, एक ही प्रकार की संरचना होती है और एक या अधिक $-CH_2$-समूहों द्वारा एक दूसरे से भिन्न होती है, कहलाती है सजातीय श्रृंखला(ग्रीक से।" होमो"- समानता)। इस श्रृंखला का प्रत्येक बाद का हाइड्रोकार्बन $-CH_2$ समूह द्वारा पिछले वाले से भिन्न होता है। इस समूह को समजातीय अंतर कहा जाता है, और इस श्रृंखला के अलग-अलग सदस्यों को समरूप कहा जाता है।
अल्केन्स के नामों की उत्पत्ति
पहले चार संतृप्त हाइड्रोकार्बन (मीथेन, ईथेन, प्रोपेन, ब्यूटेन) के नाम संयोग से उत्पन्न हुए। उदाहरण के लिए, "ईथेन" शब्द की जड़ लैटिन शब्द . से आई है ईथर- ईथर, क्योंकि शेष ईथेन $-C_2H_5$ चिकित्सा ईथर का हिस्सा है। $C_5H_(12)$ से शुरू होकर, अल्केन्स के नाम ग्रीक या लैटिन अंकों से लिए गए हैं जो किसी दिए गए संतृप्त हाइड्रोकार्बन अणु में कार्बन परमाणुओं की संख्या को इंगित करते हैं, इन नामों के साथ प्रत्यय -an जोड़ा जाता है। इस प्रकार, हाइड्रोकार्बन $C_5H_(12)$ को पेंटेन कहा जाता है (ग्रीक से " पेंटा"- पांच), $ C_6H_ (14) $ - हेक्सेन (ग्रीक से।" हेक्सा"- छह), $ C_7H_(10) $ - हेप्टेन (ग्रीक से।" हेप्टा"- सात), आदि।
व्यवस्थित नामकरण के नियम
शीर्षक के लिए कार्बनिक पदार्थइंटरनेशनल यूनियन ऑफ प्योर एंड एप्लाइड केमिस्ट्री (IUPAC) के आयोग ने व्यवस्थित (वैज्ञानिक) नामकरण के लिए नियम विकसित किए। इन नियमों के अनुसार हाइड्रोकार्बन के नाम इस प्रकार दिए गए हैं:
हाइड्रोकार्बन अणु में, मुख्य - लंबी और जटिल (जिसमें शाखाओं की संख्या सबसे अधिक होती है) - कार्बन श्रृंखला को चुना जाता है।
मुख्य श्रृंखला के कार्बन परमाणु क्रमांकित हैं।क्रमांकन श्रृंखला के अंत से क्रमिक रूप से किया जाता है, जो रेडिकल को सबसे छोटी संख्या देता है। यदि कई ऐल्किल मूलक हैं, तो दो संभावित क्रमागत संख्याओं के अंकों के आकार की तुलना की जाती है। और जिस संख्या में पहली संख्या लगातार दूसरी संख्या से कम होती है उसे "कम" माना जाता है और इसका उपयोग हाइड्रोकार्बन का नाम बनाने के लिए किया जाता है।
दाएं से बाएं की संख्या बाएं से दाएं की संख्या से "कम" होगी।
वे हाइड्रोकार्बन रेडिकल कहते हैं जो साइड चेन बनाते हैं।प्रत्येक रेडिकल के नाम से पहले, एक नंबर रखा जाता है जो मुख्य श्रृंखला के कार्बन परमाणु की संख्या को इंगित करता है, जिस पर यह रेडिकल स्थित होता है। संख्या को एक हाइफ़न द्वारा नाम से अलग किया जाता है। ऐल्किल रेडिकल्स के नाम वर्णानुक्रम में सूचीबद्ध हैं। यदि हाइड्रोकार्बन की संरचना में कई समान मूलक हैं, तो इन मूलकों वाले कार्बन परमाणुओं की संख्या आरोही क्रम में लिखी जाती है। संख्याओं को अल्पविराम द्वारा एक दूसरे से अलग किया जाता है। उपसर्गों को संख्याओं के बाद लिखा जाता है: di- (यदि दो समान मूलक हैं), त्रि- (जब तीन समान मूलक हों), टेट्रा-, पेंटा-, आदि। (यदि क्रमशः चार, पाँच, समान मूलक हैं, आदि।)। उपसर्ग इंगित करते हैं कि किसी दिए गए हाइड्रोकार्बन में कितने समान मूलक हैं। उपसर्ग के बाद मूलांक का नाम रखें। इस घटना में कि दो समान मूलक एक ही कार्बन परमाणु पर होते हैं, इस कार्बन परमाणु की संख्या को दो बार नाम में रखा जाता है।
मुख्य क्रमांकित कार्बन श्रृंखला के हाइड्रोकार्बन का नाम याद रखें, यह याद रखें कि सभी संतृप्त हाइड्रोकार्बन के नामों में प्रत्यय -an होता है।
निम्नलिखित उदाहरण आपको इन नियमों को समझने में मदद करेंगे:
चित्र 1।
साइड चेन अल्काइल रेडिकल्स
कभी-कभी पार्श्व श्रृंखलाओं के ऐल्किल मूलक शाखित होते हैं। इस मामले में, उन्हें संबंधित संतृप्त हाइड्रोकार्बन कहा जाता है, केवल प्रत्यय के बजाय - वे प्रत्यय -इल लेते हैं।
शाखित मूलक की कार्बन श्रृंखला क्रमांकित है। मुख्य श्रृंखला से जुड़े इस मूलक के कार्बन परमाणु को $1$ की संख्या प्राप्त होती है। सुविधा के लिए, एक शाखित मूलक की कार्बन श्रृंखला को अभाज्य संख्याओं के साथ क्रमांकित किया जाता है और ऐसे मूलक का पूरा नाम कोष्ठक में लिया जाता है:

चित्र 2।
तर्कसंगत नामकरण
संतृप्त हाइड्रोकार्बन के नाम के लिए व्यवस्थित नामकरण के अलावा, तर्कसंगत नामकरण का भी उपयोग किया जाता है। इस नामकरण के अनुसार, संतृप्त हाइड्रोकार्बन को मीथेन का व्युत्पन्न माना जाता है, जिसके अणु में एक या अधिक हाइड्रोजन परमाणुओं को रेडिकल द्वारा प्रतिस्थापित किया जाता है। तर्कसंगत नामकरण के अनुसार एक संतृप्त हाइड्रोकार्बन का नाम इस तरह से बनता है: जटिलता की डिग्री के अनुसार, कार्बन परमाणु पर मौजूद सभी रेडिकल्स को सबसे बड़ी संख्या में प्रतिस्थापन के रूप में नामित किया जाता है (यदि वे समान हैं तो उनकी संख्या को ध्यान में रखते हुए) ), और फिर इस नामकरण के अनुसार हाइड्रोकार्बन के नाम का आधार जोड़ा जाता है - "मीथेन" शब्द। उदाहरण के लिए:
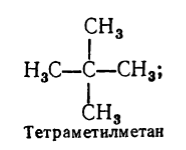
चित्र तीन
परिमेय नामकरण का उपयोग अपेक्षाकृत सरल हाइड्रोकार्बन के नाम के लिए किया जाता है। यह नामकरण व्यवस्थित नामकरण की तुलना में उतना परिष्कृत और उपयोग करने के लिए बहुत कम सुविधाजनक नहीं है। तर्कसंगत नामकरण के अनुसार, एक ही पदार्थ के अलग-अलग नाम हो सकते हैं, जो बहुत असुविधाजनक है। इसके अलावा, इस नामकरण के अनुसार सभी संतृप्त हाइड्रोकार्बन का नाम नहीं दिया जा सकता है।
हाइड्रोकार्बन, जिसके अणुओं में परमाणु एकल बंधों से जुड़े होते हैं और जो के अनुरूप होते हैं सामान्य सूत्रसी एन एच 2 एन +2।
ऐल्केन अणुओं में सभी कार्बन परमाणु sp3 संकरण की अवस्था में होते हैं। इसका अर्थ यह है कि कार्बन परमाणु के सभी चार संकर कक्षक आकार, ऊर्जा में समान हैं और एक समबाहु त्रिभुजाकार पिरामिड - एक चतुष्फलक के कोनों की ओर निर्देशित हैं। कक्षकों के बीच का कोण 109° 28' है।
एक एकल कार्बन-कार्बन बंधन के चारों ओर व्यावहारिक रूप से मुक्त रोटेशन संभव है, और अल्केन अणु टेट्राहेड्रल (109 ° 28 ) के करीब कार्बन परमाणुओं पर कोणों के साथ कई प्रकार के आकार ले सकते हैं, उदाहरण के लिए, एक अणु में एन-पेंटेन।

यह विशेष रूप से अल्केन्स के अणुओं में बंधों को याद करने लायक है। संतृप्त हाइड्रोकार्बन के अणुओं में सभी बंधन एकल होते हैं। अतिव्यापन अक्ष के अनुदिश होता है,
परमाणुओं के नाभिकों को जोड़ने वाले, अर्थात् ये -आबंध होते हैं। कार्बन-कार्बन बांड गैर-ध्रुवीय और खराब ध्रुवीकरण योग्य हैं। लंबाई सी-सी कनेक्शनअल्केन्स में यह 0.154 एनएम (1.54 10 - 10 मीटर) है। C-H बंध कुछ छोटे होते हैं। इलेक्ट्रॉन घनत्व थोड़ा अधिक विद्युत ऋणात्मक कार्बन परमाणु की ओर स्थानांतरित हो जाता है, अर्थात। एस-एन कनेक्शनकमजोर ध्रुवीय है।
संतृप्त हाइड्रोकार्बन के अणुओं में ध्रुवीय बंधों की अनुपस्थिति इस तथ्य की ओर ले जाती है कि वे पानी में खराब घुलनशील होते हैं और आवेशित कणों (आयनों) के साथ परस्पर क्रिया नहीं करते हैं। अल्केन्स की सबसे विशेषता मुक्त कणों से जुड़ी प्रतिक्रियाएं हैं।
मीथेन की समजातीय श्रृंखला
होमोलॉग्स- पदार्थ संरचना और गुणों में समान होते हैं और एक या अधिक सीएच 2 समूहों द्वारा भिन्न होते हैं।

समरूपता और नामकरण
अल्केन्स को तथाकथित द्वारा विशेषता है संरचनात्मक समरूपता. कार्बन कंकाल की संरचना में संरचनात्मक आइसोमर्स एक दूसरे से भिन्न होते हैं। सबसे सरल एल्केन, जिसकी विशेषता है संरचनात्मक समावयवी, ब्यूटेन है। 
नामकरण की मूल बातें
1. मुख्य सर्किट का चयन।हाइड्रोकार्बन के नाम का निर्माण मुख्य श्रृंखला की परिभाषा के साथ शुरू होता है - अणु में कार्बन परमाणुओं की सबसे लंबी श्रृंखला, जो कि इसका आधार था।
2. मुख्य श्रृंखला के परमाणुओं की संख्या।मुख्य श्रृंखला के परमाणुओं को नियत संख्याएँ दी जाती हैं। मुख्य श्रृंखला के परमाणुओं की संख्या प्रतिस्थापक (संरचना ए, बी) के निकटतम छोर से शुरू होती है। यदि प्रतिस्थापन श्रृंखला के अंत से समान दूरी पर हैं, तो अंकन उस छोर से शुरू होता है जिस पर उनमें से अधिक होते हैं (संरचना बी)। यदि विभिन्न प्रतिस्थापन श्रृंखला के सिरों से समान दूरी पर हैं, तो क्रमांकन उस छोर से शुरू होता है जहां पुराना वाला करीब है (संरचना G)। हाइड्रोकार्बन पदार्थों की वरिष्ठता उस क्रम से निर्धारित होती है जिसके साथ उनका नाम वर्णमाला में शुरू होता है: मिथाइल (-CH 3), फिर एथिल (-CH 2 -CH 3), प्रोपाइल (-CH 2 -CH 2) -सीएच 3) आदि।
ध्यान दें कि प्रत्यय -an को प्रत्यय के साथ प्रतिस्थापित करने से विकल्प का नाम बनता है - गादसंबंधित अल्केन के नाम पर।
3. नाम गठन. नाम की शुरुआत में संख्याओं का संकेत दिया जाता है - कार्बन परमाणुओं की संख्या जिस पर पदार्थ स्थित होते हैं। यदि किसी दिए गए परमाणु में कई स्थानापन्न हैं, तो नाम में संबंधित संख्या को दो बार अल्पविराम (2,2-) से अलग करके दोहराया जाता है। संख्या के बाद, एक हाइफ़न प्रतिस्थापनों की संख्या को इंगित करता है ( डि- दो, तीन- तीन, टेट्रा- चार, पेंटा- पांच) और प्रतिस्थापन का नाम (मिथाइल, एथिल, प्रोपाइल)। फिर रिक्त स्थान और हाइफ़न के बिना - मुख्य श्रृंखला का नाम। मुख्य श्रृंखला को हाइड्रोकार्बन के रूप में संदर्भित किया जाता है - मीथेन समरूप श्रृंखला का एक सदस्य ( मीथेनसीएच 4, एटैनसी 2 एच 6, प्रोपेनसी 3 एच 8, सी 4 एच 10, पैंटेनसी 5 एच 12, हेक्सेनसी 6 एच 14, हेपटैनसी 7 एच 16, ओकटाइनसी 8 एच 18, नॉननसी 9 एच 20, डीनसी 10 एच 22)।

अल्केन्स के भौतिक गुण
मीथेन की सजातीय श्रृंखला के पहले चार प्रतिनिधि गैस हैं। उनमें से सबसे सरल मीथेन है - एक रंगहीन, बेस्वाद और गंधहीन गैस ("गैस की गंध", जिसे महसूस करने के बाद, आपको 04 पर कॉल करने की आवश्यकता है, यह मर्कैप्टन की गंध से निर्धारित होता है - सल्फर युक्त यौगिकों को विशेष रूप से उपयोग किए जाने वाले मीथेन में जोड़ा जाता है घरेलू और औद्योगिक गैस उपकरण ताकि उनके आस-पास के लोग रिसाव को सूंघ सकें)।
सी 4 एच 12 से सी 15 एच 32 तक संरचना के हाइड्रोकार्बन - तरल पदार्थ; भारी हाइड्रोकार्बन ठोस होते हैं। एल्केन्स के क्वथनांक और गलनांक कार्बन श्रृंखला की लंबाई बढ़ने के साथ धीरे-धीरे बढ़ते हैं। सभी हाइड्रोकार्बन पानी में खराब घुलनशील होते हैं, तरल हाइड्रोकार्बन सामान्य कार्बनिक सॉल्वैंट्स होते हैं।
अल्केन्स के रासायनिक गुण
प्रतिस्थापन प्रतिक्रियाएं।
अल्केन्स की सबसे विशेषता मुक्त कट्टरपंथी प्रतिस्थापन प्रतिक्रियाएं हैं, जिसके दौरान हाइड्रोजन परमाणु को हलोजन परमाणु या किसी समूह द्वारा प्रतिस्थापित किया जाता है। आइए हम अभिलक्षणिक अभिक्रियाओं के समीकरण प्रस्तुत करें हैलोजनीकरण: 
हैलोजन की अधिकता के मामले में, क्लोरीनीकरण आगे बढ़ सकता है, क्लोरीन द्वारा सभी हाइड्रोजन परमाणुओं के पूर्ण प्रतिस्थापन तक: 
परिणामी पदार्थ कार्बनिक संश्लेषण में सॉल्वैंट्स और प्रारंभिक सामग्री के रूप में व्यापक रूप से उपयोग किए जाते हैं।
डिहाइड्रोजनीकरण प्रतिक्रिया(हाइड्रोजन विभाजन बंद).
उत्प्रेरक (Pt, Ni, Al 2 0 3, Cr 2 0 3) पर एल्केन्स के पारित होने के दौरान उच्च तापमान(400-600 डिग्री सेल्सियस) एक हाइड्रोजन अणु अलग हो जाता है और एक एल्कीन बनता है:
कार्बन श्रृंखला के विनाश के साथ प्रतिक्रियाएं।
सभी संतृप्त हाइड्रोकार्बन बनने के लिए जलते हैं कार्बन डाइऑक्साइडऔर पानी। कुछ निश्चित अनुपात में हवा के साथ मिश्रित गैसीय हाइड्रोकार्बन फट सकते हैं।
1. संतृप्त हाइड्रोकार्बन का दहनएक मुक्त मूलक एक्ज़ोथिर्मिक प्रतिक्रिया है जिसमें एक बहुत है बहुत महत्वईंधन के रूप में एल्केन्स का उपयोग करते समय:
में सामान्य रूप से देखेंएल्केन्स की दहन प्रतिक्रिया को निम्नानुसार लिखा जा सकता है:
2. हाइड्रोकार्बन का थर्मल विभाजन।
प्रक्रिया मुक्त मूलक तंत्र के अनुसार आगे बढ़ती है। तापमान में वृद्धि से कार्बन-कार्बन बंधन का होमोलिटिक टूटना और मुक्त कणों का निर्माण होता है।
ये रेडिकल एक दूसरे के साथ बातचीत करते हैं, एक हाइड्रोजन परमाणु का आदान-प्रदान करते हैं, एक अल्केन अणु और एक एल्केन अणु के निर्माण के साथ:
थर्मल विभाजन प्रतिक्रियाएं औद्योगिक प्रक्रिया के अंतर्गत आती हैं - हाइड्रोकार्बन क्रैकिंग। यह प्रक्रिया तेल शोधन का सबसे महत्वपूर्ण चरण है।
3. पायरोलिसिस. जब मीथेन को 1000 डिग्री सेल्सियस के तापमान पर गर्म किया जाता है, तो मीथेन का पायरोलिसिस शुरू होता है - सरल पदार्थों में अपघटन: ![]()
1500 डिग्री सेल्सियस के तापमान पर गर्म करने पर एसिटिलीन का निर्माण संभव है:
4. आइसोमराइज़ेशन. जब रैखिक हाइड्रोकार्बन को एक आइसोमेराइजेशन उत्प्रेरक (एल्यूमीनियम क्लोराइड) के साथ गर्म किया जाता है, तो एक शाखित कार्बन कंकाल वाले पदार्थ बनते हैं: 
5. गंध. उत्प्रेरक की उपस्थिति में श्रृंखला में छह या अधिक कार्बन परमाणुओं वाले अल्केन्स को बेंजीन और इसके डेरिवेटिव बनाने के लिए चक्रित किया जाता है: 
अल्केन्स प्रतिक्रियाओं में प्रवेश करते हैं जो मुक्त कट्टरपंथी तंत्र के अनुसार आगे बढ़ते हैं, क्योंकि अल्केन अणुओं में सभी कार्बन परमाणु एसपी 3 संकरण की स्थिति में होते हैं। इन पदार्थों के अणु सहसंयोजक गैर-ध्रुवीय सी-सी (कार्बन-कार्बन) बंधनों और कमजोर ध्रुवीय सी-एच (कार्बन-हाइड्रोजन) बंधनों का उपयोग करके बनाए जाते हैं। उनके पास उच्च और निम्न इलेक्ट्रॉन घनत्व वाले क्षेत्र नहीं होते हैं, आसानी से ध्रुवीकरण करने योग्य बंधन, यानी ऐसे बंधन, इलेक्ट्रॉन घनत्व जिसमें की कार्रवाई के तहत स्थानांतरित किया जा सकता है बाहरी कारक(आयनों के इलेक्ट्रोस्टैटिक क्षेत्र)। नतीजतन, अल्केन्स आवेशित कणों के साथ प्रतिक्रिया नहीं करेंगे, क्योंकि अल्केन अणुओं में बांड एक हेटेरोलाइटिक तंत्र द्वारा नहीं तोड़े जाते हैं। 
सबसे सरल कार्बनिक यौगिक हैं हाइड्रोकार्बनकार्बन और हाइड्रोजन से बना है। हाइड्रोकार्बन में रासायनिक बंधों की प्रकृति और कार्बन और हाइड्रोजन के अनुपात के आधार पर, उन्हें संतृप्त और असंतृप्त (एल्किन्स, अल्काइन्स, आदि) में विभाजित किया जाता है।
सीमितहाइड्रोकार्बन (अल्केन्स, मीथेन श्रृंखला के हाइड्रोकार्बन) हाइड्रोजन के साथ कार्बन के यौगिक हैं, जिनके अणुओं में प्रत्येक कार्बन परमाणु किसी अन्य पड़ोसी परमाणु से जुड़ने के लिए एक से अधिक वैलेंस खर्च नहीं करता है, और सभी वैलेंस कार्बन के साथ कनेक्शन पर खर्च नहीं किए जाते हैं। हाइड्रोजन से संतृप्त हैं। ऐल्केन में सभी कार्बन परमाणु sp3 अवस्था में होते हैं। सीमा हाइड्रोकार्बन सामान्य सूत्र द्वारा विशेषता एक समरूप श्रृंखला बनाते हैं से एन एच 2एन+2. इस श्रृंखला का पूर्वज मीथेन है।
समरूपता। नामपद्धति।
n=1,2,3 वाले अल्केन्स केवल एक आइसोमर के रूप में मौजूद हो सकते हैं
n=4 से शुरू होकर, संरचनात्मक समरूपता की घटना प्रकट होती है।

कार्बन परमाणुओं की संख्या में वृद्धि के साथ एल्केन्स के संरचनात्मक आइसोमर्स की संख्या तेजी से बढ़ती है, उदाहरण के लिए, पेंटेन में 3 आइसोमर हैं, हेप्टेन में 9 हैं, आदि।
संभावित स्टीरियोइसोमर्स के कारण एल्केन आइसोमर्स की संख्या भी बढ़ जाती है। सी 7 एच 16 से शुरू होकर, चिरल अणुओं का अस्तित्व संभव है, जो दो एनैन्टीओमर बनाते हैं।
अल्केन्स नामकरण।
प्रमुख नामकरण IUPAC नामकरण है। साथ ही, इसमें तुच्छ नामों के तत्व शामिल हैं। इस प्रकार, अल्केन्स की समजातीय श्रृंखला के पहले चार सदस्यों के तुच्छ नाम हैं।
सीएच 4 - मीथेन
सी 2 एच 6 - ईथेन
सी 3 एच 8 - प्रोपेन
सी 4 एच 10 - ब्यूटेन।
शेष समरूपों के नाम ग्रीक लैटिन अंकों से लिए गए हैं। तो, सामान्य (अशाखित) संरचना की एक श्रृंखला के निम्नलिखित सदस्यों के लिए, नामों का उपयोग किया जाता है:
सी 5 एच 12 - पेंटेन, सी 6 एच 14 - हेक्सेन, सी 7 एच 18 - हेप्टेन,
सी 14 एच 30 - टेट्राडेकेन, सी 15 एच 32 - पेंटाडेकेन, आदि।
शाखित अल्केन्स के लिए बुनियादी IUPAC नियम
ए) सबसे लंबी अशाखित श्रृंखला चुनें, जिसका नाम आधार (रूट) है। इस तने में प्रत्यय "अ" जोड़ा जाता है।
बी) इस श्रृंखला को कम से कम स्थानीय लोगों के सिद्धांत के अनुसार संख्या दें,
ग) स्थान को इंगित करते हुए, स्थान को वर्णानुक्रम में उपसर्गों के रूप में दर्शाया गया है। यदि मूल संरचना में कई समान स्थानापन्न हैं, तो उनकी संख्या ग्रीक अंकों द्वारा इंगित की जाती है।
अन्य कार्बन परमाणुओं की संख्या के आधार पर जिनके साथ माना गया कार्बन परमाणु सीधे जुड़ा हुआ है, प्रतिष्ठित हैं: प्राथमिक, माध्यमिक, तृतीयक और चतुर्धातुक कार्बन परमाणु।


शाखित ऐल्केनों में प्रतिस्थापकों के रूप में ऐल्किल समूह या ऐल्किल मूलक प्रकट होते हैं, जिन्हें ऐल्केन अणु से एक हाइड्रोजन परमाणु के उन्मूलन के परिणाम के रूप में माना जाता है।
अंतिम प्रत्यय "a" को प्रत्यय "il" से बदलकर संबंधित अल्केन्स के नाम से एल्काइल समूहों का नाम बनता है।
सीएच 3 - मिथाइल
सीएच 3 सीएच 2 - एथिल
सीएच 3 सीएच 2 सीएच 2 - प्रोपाइल

शाखित एल्काइल समूहों के नाम के लिए, श्रृंखला क्रमांकन का भी उपयोग किया जाता है:

ईथेन से शुरू होकर, अल्केन्स कन्फर्मर्स बनाने में सक्षम होते हैं, जो कि बाधित रचना के अनुरूप होते हैं। ग्रहण के माध्यम से एक बाधा से दूसरे में संक्रमण की संभावना रोटेशन बाधा द्वारा निर्धारित की जाती है। संरचना का निर्धारण, कंफर्मर्स की संरचना, और रोटेशन के लिए बाधाएं, गठनात्मक विश्लेषण के कार्य हैं। एल्केन्स प्राप्त करने की विधियाँ।
1. आंशिक आसवन प्राकृतिक गैसया तेल का गैसोलीन अंश।इस तरह, 11 कार्बन परमाणुओं तक के अलग-अलग अल्केन्स को अलग किया जा सकता है।
2. कोयले का हाइड्रोजनीकरण।प्रक्रिया को उत्प्रेरक (मोलिब्डेनम, टंगस्टन, निकल के ऑक्साइड और सल्फाइड) की उपस्थिति में 450-470 सी पर और 30 एमपीए तक दबाव में किया जाता है। कोयले और उत्प्रेरक को पाउडर में मिलाया जाता है और निलंबन के माध्यम से हाइड्रोजन को बुदबुदाते हुए निलंबन में हाइड्रोजनीकृत किया जाता है। अल्केन्स और साइक्लोअल्केन्स के परिणामी मिश्रण का उपयोग मोटर ईंधन के रूप में किया जाता है।
3. CO और CO . का हाइड्रोजनीकरण 2 .
सीओ + एच 2 अल्केन्स
सीओ 2 + एच 2 अल्केन्स
Co, Fe, आदि इन अभिक्रियाओं के लिए उत्प्रेरक के रूप में उपयोग किए जाते हैं।d - तत्व।
4.ऐल्कीनों और ऐल्कीनों का हाइड्रोजनीकरण।

5.ऑर्गोमेटेलिक संश्लेषण।
लेकिन)। वर्ट्ज़ संश्लेषण।
2RHal + 2Na R R + 2NaHal
यदि कार्बनिक अभिकर्मकों के रूप में दो भिन्न हैलोऐल्केनों का उपयोग किया जाए तो यह संश्लेषण बहुत कम उपयोग में आता है।
बी)। ग्रिग्नार्ड अभिकर्मकों का प्रोटोलिसिस।
आर हैल + एमजी आरएमजीएचएल
RMgHal + HOH RH + Mg(OH)Hal
में)। अल्काइल हैलाइड के साथ लिथियम डायलकाइलक्यूप्रेट्स (LiR 2 Cu) की प्रतिक्रिया
LiR 2 Cu + R X R R + RCu + LiX
लिथियम डायलकाइलक्यूप्रेट स्वयं दो-चरण विधि में प्राप्त किए जाते हैं
2R ली + CuI LiR 2 Cu + LiI
6. कार्बोक्जिलिक एसिड (कोल्बे संश्लेषण) के लवण का इलेक्ट्रोलिसिस।
2RCOONA + 2H 2 O R R + 2CO 2 + 2NaOH + H 2

7. कार्बोक्सिलिक अम्लों के लवणों का क्षार के साथ संलयन।
प्रतिक्रिया का उपयोग निचले अल्केन्स को संश्लेषित करने के लिए किया जाता है।
8.कार्बोनिल यौगिकों और हेलोऐल्केनों का हाइड्रोजेनोलिसिस।
लेकिन)। कार्बोनिल यौगिक। क्लेमेंस का संश्लेषण।

बी)। हलोजन एल्केन्स। उत्प्रेरक हाइड्रोजनोलिसिस।
![]()
Ni, Pt, Pd का उपयोग उत्प्रेरक के रूप में किया जाता है।
ग) हैलोजन एल्केन्स। प्रतिक्रियाशील वसूली।
आरएचएल + 2HI आरएच + एचएचएल + आई 2
एल्केन्स के रासायनिक गुण।
अल्केन्स में सभी बंधन कम ध्रुवता के होते हैं, इसलिए, उन्हें कट्टरपंथी प्रतिक्रियाओं की विशेषता होती है। पाई बंधों की अनुपस्थिति जोड़ अभिक्रियाओं को असंभव बना देती है। अल्केन्स को प्रतिस्थापन, उन्मूलन और दहन प्रतिक्रियाओं की विशेषता है।
|
प्रतिक्रिया का प्रकार और नाम | |
|
1. प्रतिस्थापन प्रतिक्रियाएं | |
|
ए) हलोजन के साथ(से क्लोरीनक्लोरीन 2 - प्रकाश में, बीआर 2 - गरम होने पर) प्रतिक्रिया का पालन करता है मार्कोवनिक का नियम (मार्कोवनिकोव के नियम)) - सबसे पहले, हैलोजन हाइड्रोजन को कम से कम हाइड्रोजनीकृत कार्बन परमाणु से बदल देता है। प्रतिक्रिया चरणों में होती है - एक चरण में एक से अधिक हाइड्रोजन परमाणु को प्रतिस्थापित नहीं किया जाता है। आयोडीन सबसे कठिन प्रतिक्रिया करता है, और इसके अलावा, प्रतिक्रिया अंत तक नहीं जाती है, उदाहरण के लिए, जब मीथेन आयोडीन के साथ प्रतिक्रिया करता है, तो हाइड्रोजन आयोडाइड बनता है, जो मीथेन और आयोडीन (प्रतिवर्ती प्रतिक्रिया) बनाने के लिए मिथाइल आयोडाइड के साथ प्रतिक्रिया करता है: |
सीएच 4 + सीएल 2 → सीएच 3 सीएल + एचसीएल (क्लोरोमेथेन) सीएच 3 सीएल + सीएल 2 → सीएच 2 सीएल 2 + एचसीएल (डाइक्लोरोमेथेन) सीएच 2 सीएल 2 + सीएल 2 → सीएचसीएल 3 + एचसीएल (ट्राइक्लोरोमेथेन) सीएचसीएल 3 + सीएल 2 → सीसीएल 4 + एचसीएल (टेट्राक्लोरोमेथेन)। |
|
बी) नाइट्रेशन (कोनोवलोव की प्रतिक्रिया) अल्केन्स नाइट्रिक एसिड या नाइट्रोजन ऑक्साइड एन 2 ओ 4 के 10% समाधान के साथ गैस चरण में 140 डिग्री के तापमान पर प्रतिक्रिया करता है और नाइट्रो डेरिवेटिव बनाने के लिए कम दबाव होता है। प्रतिक्रिया भी मार्कोवनिकोव के नियम का पालन करती है। हाइड्रोजन परमाणुओं में से एक को NO 2 अवशेष (नाइट्रो समूह) द्वारा प्रतिस्थापित किया जाता है और पानी छोड़ा जाता है |
|
|
2. उन्मूलन प्रतिक्रियाएं | |
|
ए) डिहाइड्रोजनीकरण- हाइड्रोजन को हटाना। प्रतिक्रिया की स्थिति उत्प्रेरक-प्लैटिनम और तापमान। |
सीएच 3 - सीएच 3 → सीएच 2 \u003d सीएच 2 + एच 2 |
|
बी) क्रैकिंगहाइड्रोकार्बन के ऊष्मीय अपघटन की प्रक्रिया, जो एक छोटी श्रृंखला के साथ यौगिकों के निर्माण के साथ बड़े अणुओं की कार्बन श्रृंखला को विभाजित करने की प्रतिक्रियाओं पर आधारित है। 450-700 o C के तापमान पर, C-C बॉन्ड के टूटने के कारण अल्केन्स विघटित हो जाते हैं (इस तापमान पर मजबूत C-H बॉन्ड बनाए रखा जाता है) और कम संख्या में कार्बन परमाणुओं के साथ अल्केन्स और अल्कीन बनते हैं। |
सी 6 एच 14 सी 2 एच 6 + सी 4 एच 8 |
|
सी) पूर्ण थर्मल अपघटन |
सीएच 4 सी + 2 एच 2 |
|
3. ऑक्सीकरण प्रतिक्रियाएं | |
|
ए) दहन प्रतिक्रियाजब प्रज्वलित किया जाता है (t = 600 o C), अल्केन्स ऑक्सीजन के साथ प्रतिक्रिया करते हैं, जबकि वे कार्बन डाइऑक्साइड और पानी में ऑक्सीकृत हो जाते हैं। |
एन Н 2एन+2 + ओ 2 -> सीओ 2 + एच 2 ओ + क्यू सीएच 4 + 2 ओ 2 -> सीओ 2 + 2 एच 2 ओ + क्यू |
|
बी) उत्प्रेरक ऑक्सीकरण- अपेक्षाकृत कम तापमान पर और उत्प्रेरक के उपयोग के साथ, यह सी-सी बॉन्ड के केवल एक हिस्से को तोड़ने के साथ होता है, लगभग अणु और सी-एच के बीच में, और मूल्यवान उत्पाद प्राप्त करने के लिए उपयोग किया जाता है: कार्बोक्जिलिक एसिड, कीटोन्स, एल्डिहाइड, अल्कोहल। |
उदाहरण के लिए, ब्यूटेन के अपूर्ण ऑक्सीकरण (सी 2-सी 3 बंधन को तोड़कर) के साथ, एसिटिक एसिड प्राप्त होता है |
|
4. आइसोमेराइजेशन प्रतिक्रियाएं सभी अल्केन्स के लिए विशिष्ट नहीं। कुछ आइसोमर्स को दूसरों में परिवर्तित करने की संभावना पर ध्यान आकर्षित किया जाता है, उत्प्रेरक की उपस्थिति। |
सी 4 एच 10 सी 4 एच 10 |
|
5.. 6 या अधिक कार्बन बैकबोन वाले अल्केन्स प्रतिक्रिया भी करें निर्जलीकरण, लेकिन हमेशा एक 6-सदस्यीय चक्र (साइक्लोहेक्सेन और इसके डेरिवेटिव) बनाते हैं। प्रतिक्रिया की स्थिति के तहत, यह चक्र आगे डीहाइड्रोजनीकरण से गुजरता है और एक सुगंधित हाइड्रोकार्बन (एरीन) के ऊर्जावान रूप से अधिक स्थिर बेंजीन चक्र में बदल जाता है। |
|
हलोजन प्रतिक्रिया का तंत्र:
हैलोजनीकरण
अल्केन्स का हलोजन एक कट्टरपंथी तंत्र द्वारा आगे बढ़ता है। प्रतिक्रिया शुरू करने के लिए, अल्केन और हैलोजन के मिश्रण को यूवी प्रकाश से विकिरणित किया जाना चाहिए या गर्म किया जाना चाहिए। मीथेन का क्लोरीनीकरण मिथाइल क्लोराइड प्राप्त करने के चरण में नहीं रुकता है (यदि क्लोरीन और मीथेन की समतुल्य मात्रा ली जाती है), लेकिन मिथाइल क्लोराइड से कार्बन टेट्राक्लोराइड तक सभी संभावित प्रतिस्थापन उत्पादों के निर्माण की ओर जाता है। अन्य अल्केन्स के क्लोरीनीकरण के परिणामस्वरूप विभिन्न कार्बन परमाणुओं में हाइड्रोजन प्रतिस्थापन उत्पादों का मिश्रण होता है। क्लोरीनीकरण उत्पादों का अनुपात तापमान पर निर्भर करता है। प्राथमिक, द्वितीयक और तृतीयक परमाणुओं के क्लोरीनीकरण की दर तापमान पर निर्भर करती है; कम तापमान पर, श्रृंखला में दर घट जाती है: तृतीयक, माध्यमिक, प्राथमिक। जैसे-जैसे तापमान बढ़ता है, गति के बीच का अंतर कम हो जाता है जब तक कि यह समान न हो जाए। गतिज कारक के अलावा, क्लोरीनीकरण उत्पादों का वितरण एक सांख्यिकीय कारक से प्रभावित होता है: तृतीयक कार्बन परमाणु पर क्लोरीन के हमले की संभावना प्राथमिक एक से 3 गुना कम और द्वितीयक से दो गुना कम होती है। इस प्रकार, अल्केन्स का क्लोरीनीकरण एक गैर-स्टीरियोसेलेक्टिव प्रतिक्रिया है, उन मामलों को छोड़कर जहां केवल एक मोनोक्लोरिनेशन उत्पाद संभव है।
हलोजनीकरण प्रतिस्थापन प्रतिक्रियाओं में से एक है। अल्केन्स का हलोजन मार्कोवनिक नियम (मार्कोवनिकोव के नियम) का पालन करता है - सबसे कम हाइड्रोजनीकृत कार्बन परमाणु पहले हलोजन होता है। एल्केन्स का हैलोजनीकरण चरणों में होता है - एक चरण में एक से अधिक हाइड्रोजन परमाणु हैलोजन नहीं होते हैं।
सीएच 4 + सीएल 2 → सीएच 3 सीएल + एचसीएल (क्लोरोमेथेन)
सीएच 3 सीएल + सीएल 2 → सीएच 2 सीएल 2 + एचसीएल (डाइक्लोरोमेथेन)
सीएच 2 सीएल 2 + सीएल 2 → सीएचसीएल 3 + एचसीएल (ट्राइक्लोरोमेथेन)
सीएचसीएल 3 + सीएल 2 → सीसीएल 4 + एचसीएल (टेट्राक्लोरोमेथेन)।
प्रकाश की क्रिया के तहत, क्लोरीन अणु परमाणुओं में विघटित हो जाता है, फिर वे मीथेन अणुओं पर हमला करते हैं, उनके हाइड्रोजन परमाणु को फाड़ते हैं, जिसके परिणामस्वरूप मिथाइल रेडिकल सीएच 3 बनते हैं, जो क्लोरीन अणुओं से टकराते हैं, उन्हें नष्ट करते हैं और नए रेडिकल बनाते हैं। .
नाइट्रेशन (कोनोवलोव की प्रतिक्रिया)
अल्केन्स नाइट्रिक एसिड या नाइट्रोजन ऑक्साइड एन 2 ओ 4 के 10% समाधान के साथ गैस चरण में 140 डिग्री के तापमान पर प्रतिक्रिया करता है और नाइट्रो डेरिवेटिव बनाने के लिए कम दबाव होता है। प्रतिक्रिया भी मार्कोवनिकोव के नियम का पालन करती है।
आरएच + एचएनओ 3 \u003d आरएनओ 2 + एच 2 ओ
यानी, हाइड्रोजन परमाणुओं में से एक को NO 2 अवशेष (नाइट्रो समूह) द्वारा प्रतिस्थापित किया जाता है और पानी छोड़ा जाता है।
आइसोमर्स की संरचनात्मक विशेषताएं इस प्रतिक्रिया के पाठ्यक्रम को दृढ़ता से प्रभावित करती हैं, क्योंकि यह सबसे आसानी से एसआई अवशेषों (केवल कुछ आइसोमर्स में उपलब्ध) में हाइड्रोजन परमाणु के लिए नाइट्रो समूह के प्रतिस्थापन की ओर जाता है, सीएच 2 समूह में हाइड्रोजन है कम आसानी से बदला गया और इससे भी अधिक कठिन - सीएच 3 अवशेषों में।
पैराफिन को नाइट्रोजन डाइऑक्साइड या नाइट्रिक एसिड वाष्प के साथ 150-475 डिग्री सेल्सियस पर गैस चरण में आसानी से नाइट्रेट किया जाता है; उसी समय आंशिक रूप से होता है और। ऑक्सीकरण। मीथेन का नाइट्रेशन लगभग विशेष रूप से नाइट्रोमीथेन का उत्पादन करता है:
सभी उपलब्ध डेटा एक मुक्त कट्टरपंथी तंत्र की ओर इशारा करते हैं। प्रतिक्रिया के परिणामस्वरूप, उत्पादों के मिश्रण बनते हैं। साधारण तापमान पर नाइट्रिक एसिड का पैराफिनिक हाइड्रोकार्बन पर लगभग कोई प्रभाव नहीं पड़ता है। गर्म होने पर, यह मुख्य रूप से ऑक्सीकरण एजेंट के रूप में कार्य करता है। हालांकि, जैसा कि एम। आई। कोनोवलोव (1889) ने पाया, गर्म होने पर, नाइट्रिक एसिड "नाइट्रेटिंग" तरीके से काम करता है; कमजोर नाइट्रिक एसिड के साथ नाइट्रेशन प्रतिक्रिया विशेष रूप से गर्म होने पर और उच्च दबाव में अच्छी तरह से आगे बढ़ती है। नाइट्रेशन प्रतिक्रिया समीकरण द्वारा व्यक्त की जाती है।
मीथेन के बाद के होमोलॉग्स अलग-अलग नाइट्रोपरैफिन का मिश्रण देते हैं, जो साथ-साथ विभाजन के कारण होता है। जब एथेन को नाइट्रेट किया जाता है, तो नाइट्रोइथेन सीएच 3 -सीएच 2 -एनओ 2 और नाइट्रोमेथेन सीएच 3 -एनओ 2 प्राप्त होते हैं। प्रोपेन से नाइट्रोपैराफिन का मिश्रण बनता है:
गैस चरण में पैराफिन का नाइट्रेशन अब औद्योगिक पैमाने पर किया जाता है।
सल्फाक्लोरिनेशन:
एक व्यावहारिक रूप से महत्वपूर्ण प्रतिक्रिया अल्केन्स का सल्फोक्लोरीनीकरण है। जब एक अल्केन विकिरण के दौरान क्लोरीन और सल्फर डाइऑक्साइड के साथ परस्पर क्रिया करता है, तो हाइड्रोजन को क्लोरोसल्फोनील समूह द्वारा प्रतिस्थापित किया जाता है:

इस प्रतिक्रिया के चरण हैं:
सीएल+आर:एच→आर+एचसीएल
आर + एसओ 2 → आरएसओ 2
आरएसओ 2 + सीएल: सीएल → आरएसओ 2 सीएल + सीएल
अल्केनसल्फोनिक क्लोराइड आसानी से अल्केनसल्फोक्सिलेट्स (आरएसओ 2 ओएच) के लिए हाइड्रोलाइज्ड होते हैं, जिनके सोडियम नमक (आरएसओ 3 ¯ ना + - सोडियम अल्केन सल्फोनेट) साबुन के समान गुण प्रदर्शित करते हैं और डिटर्जेंट के रूप में उपयोग किए जाते हैं।











